Das “French Paradox” beschreibt das Phänomen, dass der moderate Konsum von Wein, insbesondere von Rotwein, eine gesundheitsfördernde Wirkung, wie z.B. die Verringerung des Risikos für koronare Herzerkrankungen, haben soll. [1, 2] Geringe Mengen Alkohol und die enthaltenen Polyphenole gelten als die dafür verantwortlichen Inhaltsstoffe. [2] Die antioxidativen Eigenschaften der Polyphenole – sekundäre Pflanzeninhaltsstoffe – spielen laut aktueller Erkenntnisse dabei unter anderem eine wichtige Rolle. [3]
Definition Antioxidans
Im weitesten Sinne lässt sich eine Antioxidans als eine Substanz beschreiben, die den oxidativen Schaden eines Zielmoleküls (z. B. mehrfach ungesättigte Fettsäuren) verzögert, verhindert oder beseitigt. Häufig liegt die antioxidativ wirksame Substanz dabei in niedrigeren Konzentrationen vor als die durch Oxidation veränderte Substanz. [4]
Antioxidantien als Radikalfänger
Molekularer Sauerstoff (O2), wie er in der Atemluft vorkommt, ist ein starkes Oxidationsmittel. Wird er chemisch oder physikalisch aktiviert, entstehen reaktive Sauerstoffspezies, sogenannte ROS (Reactive Oxygen Species), die z. T. Radikalcharakter besitzen. Radikale besitzen anstelle von paarigen Elektronen – die einen stabilen Zustand darstellen – ein oder mehrere ungepaarte Elektronen und sind aus diesem Grund besonders „reaktiv”. Es handelt sich bei den ROS also um reaktionsfreudige, aggressive Sauerstoffmoleküle, welche im Organismus z. B. Zellstrukturen und Nukleinsäuren schädigen können, indem die chemische Struktur der einzelnen Bausteine durch Oxidationsreaktionen modifiziert wird.
Beispiele für ROS sind z. B. „freie Radikale” wie das Hyperoxid-Anion (O2·?) und das Hydroxylradikal (OH·). Wasserstoffperoxid (H2O2), Ozon (O3) und Hydroperoxide (ROOH) zählen hingegen zu den nicht-radikalischen ROS. ROS entstehen fortwährend bei Stoffwechselprozessen, überwiegend bei der Zellatmung in den Mitochondrien, aber auch durch Strahlung oder Chemikalien.
Antioxidantien sind Antioxidationsmittel und fungieren als Radikalfänger, das heißt sie werden bei Anwesenheit von ROS bevorzugt oxidiert. Im menschlichen Organismus verhindern sie auf diese Weise als Abwehrstoffe Schäden an Zellmembranen (Lipidperoxidation), Proteinen, Kohlenhydraten und Nukleinsäuren, die durch Oxidantien (ROS) verursacht werden. Es gibt verschiedene Regenerationsmechanismen für die verbrauchten Antioxidantien, sodass häufig kleine Konzentrationen ausreichen, um Zellsysteme effektiv vor oxidativen Schäden zu schützen.
Einteilung der Antioxidantien
Im Zusammenhang mit Lebensmitteln lassen sich antioxidativ wirkende Inhaltsstoffe nach verschiedenen Kriterien unterteilen. Zunächst ist die Einteilung in natürlich vorkommende und synthetisch zugesetzte Antioxidantien sinnvoll. Der Zusatz ist insbesondere bei fettreichen Lebensmitteln relevant, da Lipide in Anwesenheit von Sauerstoff der Lipidoxidation unterliegen, wodurch aromawirksame, flüchtige Verbindungen entstehen, die zu einem „ranzigen“ Fehlaroma führen. Antioxidantien zögern den Verderb somit hinaus. [5]
Natürliche Antioxidantien
Pflanzliche und tierische Organismen verfügen über unterschiedliche Werkzeuge, um dem oxidativen Schaden von Körperzellen und Molekülen, wie z.B. Proteinen, Lipiden und DNA, vorzubeugen und entgegenzuwirken. Zum einen sind dies Enzyme und zum anderen nicht-enzymatische Antioxidantien. [5, 6]
Die Enzyme Superoxiddismutase, Katalase und Glutathionperoxidase bieten den primären enzymatischen Schutz vor oxidativen Schäden, indem sie die Bildung von freien Radikalen direkt verhindern oder diese abfangen. Unter dem sekundären enzymatischen Schutz versteht man die Aktivität der Enzyme Glutathionreduktase und Glucose-6-phosphatdehydrogenase, welche indirekten Einfluss auf die Radikalbildung nehmen, z. B. durch die Produktion des Reduktionsmittels NADPH. NADPH ist dann in der Lage Radikale bzw. reaktive Sauerstoffspezies abzufangen. [6]
Nicht-enzymatische Antioxidantien lassen sich anhand ihrer chemischen Struktur in verschiedene Untergruppen einteilen. Im Folgenden werden die wichtigsten Gruppen und einige zugehörige Vertreter vorgestellt.
Zu den antioxidativ wirksamen Vitaminen zählen Ascorbinsäure (Vitamin C) und die Tocopherole (Vitamin E). Die Carotinoide, wie z. B. das ß-Carotin (Provitamin von Vitamin A), Lycopin oder das Lutein, bilden eine weitere Untergruppe. Weitere Gruppen bilden die enzymatischen Cofaktoren (z. B. Ubichinon 10, ?-Liponsäure), einige Mineralien (Zink und Selen), Stickstoffverbindungen (z. B. Harnsäure) und die Peptide wie das Glutathion. [5, 6]
Eine große Untergruppe der nicht-enzymatischen Antioxidantien bilden die phenolischen Verbindungen oder auch Polyphenole, die meist einen pflanzlichen Ursprung besitzen. Sie unterteilen sich wiederum in verschiedene Untergruppen von denen einige Wesentliche hier genannt werden.
Dazu gehören die Hydroxyzimtsäuren, wie z. B. Cumar- oder Kaffeesäure, die auch Bestandteile des Lignins sind. Phenolcarbonsäuren, wie die Gallussäure, bilden eine weitere Untergruppe aus denen sich die hydrolysierbaren Gerbstoffe ableiten. Zuletzt gehören auch die Stilbene (z. B. Resveratrol in Wein) und die Flavonoide zu den phenolischen Verbindungen. In dieser großen Klasse der Flavonoide werden verschiedenste Pflanzenstoffe zusammengefasst, so z. B. die Anthocyane (Beeren- und Traubenfarbstoffe Cyanidin und Malvidin), Flavon-3-ole (Quercetin in Äpfeln und Zwiebeln), Flavan-3-ole (Catechine in Tee) und Isoflavone (Genistein in Soja).
Durch die Nahrungsaufnahme von pflanzlichen oder tierischen Produkten nimmt der Konsument sowohl die Enzyme als auch die nicht-enzymatischen Antioxidantien zu sich. Die ernährungsphysiologische Wirkung der einzelnen Gruppen lässt sich aufgrund der unterschiedlich guten Resorption und des variierend starken Abbaus im Gastrointestinal-Trakt schwer abschwätzen.
Synthetische Antioxidantien
Vielen industriell produzierten Lebensmitteln und auch pharmazeutischen Produkten werden synthetische Antioxidantien zwecks besserer Haltbarkeit zugesetzt. Erkennbar sind diese Zusatzstoffe an einer E-Nummer mit der Zahl 3, z. B. E 320). Einige Voraussetzungen müssen von diesen Substanzen erfüllt werden, damit sie in der Praxis einsetzbar sind. Sie dürfen keinerlei Toxizität aufweisen und sollten schon in geringen Mengen 0,01-0,02 % hochwirksam sein. Außerdem ist eine Veränderung der Stoffe während der Lebensmittelverarbeitung unerwünscht („carry-through-effect“). Zu den häufig eingesetzten Vertretern zählen Butylhydroxyanisol (BHA), Butylhydroxytoluol (BHT) und Dodecylgallat. [5, 6]
Studien geben Hinweise darauf, dass synthetische Antioxidantien eine kanzerogene Wirkung besitzen könnten, weshalb nach natürlichen und ebenso wirksamen Alternativen gesucht wird. [6]
Lebensmittel als Quelle für Antioxidantien
Neben körpereigenen Mechanismen zur Verhinderung unerwünschter Oxidationen, ist es insbesondere die Ernährung, über die ein breites Spektrum antioxidativ wirksamer Stoffe aufgenommen wird.
Zahlreiche Nahrungs- und Genussmittel enthalten natürliche Antioxidantien. So sind z. B. Kaffee, Gewürze, Rotkohl, Granatapfel und Rotwein reich an Polyphenolen; verschiedene Obst- und Gemüsesorten enthalten viele Carotinoide und Vitamin C; Pflanzenöl und Nüsse sind reich an Vitamin E; Paranuss, Getreide und Fleisch enthalten Selen und Spinat, Muskelfleisch sowie Innereien liefern ?-Liponsäure.
Bei der Krebsbekämpfung werden Antioxidantien zur Prävention und Therapie verwendet. Signifikante Inhibitoren sind z. B. das Flavon-3-ol Quercetin, die Flavone Apigenin und Luteolin sowie die Isoflavone Daidzein und Genistein. [7] Diese phenolischen Verbindungen werden in erster Linie von Nahrungsmitteln mit pflanzlicher Herkunft geliefert, ebenso wie die essentiellen, antioxidativ wirkenden Vitamine C und E und das Spurenelement Selen.
Dem Schutz von fettreichen Lebensmitteln und Gerichten, wie z. B. Hammelfleisch, gerade in den wärmeren Klimagebieten, dienen Antioxidantien-haltige Gewürze und Kräuter. Beispiele sind Salbei (Salvia sp.) und Rosmarin (Rosmarinus officinalis) mit den antioxidativ wirkenden Inhaltsstoffen Carnosol und Carnosolsäure, die auch zum bitteren Geschmack der beiden Kräuter beitragen. Der Rheinberger Underberg ist durch die Vielfalt an Kräutern, die bei der Herstellung verwendet werden, ebenfalls besonders reich an Antioxidantien. [8]
Was ist dran am „French Paradox“?
Das Phänomen, welches heute als das „French Paradox“ bekannt ist, wurde erstmals 1992 erwähnt. In der französischen Bevölkerung wurde trotz eines hohen Konsums an gesättigten Fetten durch z. B. Fleischverzehr eine sehr geringe Häufigkeit für kardiovaskuläre Erkrankungen beobachtet. Aufgrund des regelmäßigen, moderaten Weinkonsums in dieser Kultur, wurde speziell für Rotwein eine positive Wirkung auf die Gesundheit vermutet. Diese sei neben dem Alkoholgehalt auf die enthaltenen Polyphenole, insbesondere das Resveratrol, zurückzuführen. [9, 10]
Zunächst sind Studien zum Nachweis positiver Wirkungen durch Alkohol schwierig durchzuführen und vorsichtig zu interpretieren. Es gibt Hinweise auf eine Verbesserung des Lipoproteinstoffwechsels durch Ethanol. [11] Ergebnisse hierzu dürfen nicht isoliert betrachtet werden, sondern sind im Kontext mit Nebenwirkungen und Begleiterscheinungen zu gewichten. Einige der negativen Auswirkungen nehmen mit erhöhtem und regelmäßigem Alkoholkonsum zu und übertreffen dann die positiven (vgl. Abbildung J-Kurve [12], abgeleitet aus der Studie von Corrao et al. [13] und bestätigt durch nachfolgende Metaanalysen [14]). Eindeutige Nachweise für eine die Gesundheit fördernde Wirkung des Alkohols fehlen. [9, 10]
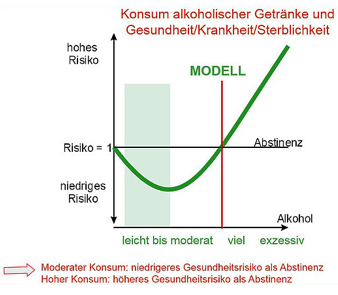
Anders verhält es sich mit der Wirkung von Polyphenolen, die z. B. verarbeitungsbedingt besonders in Rotwein, aber auch in Kräuterspirituosen vorkommen. [8, 11] Zu den Wirkungen der Polyphenole im Organismus zählen z. B. die Interaktion mit zellulären Signalwegen, die Wechselwirkung mit DNA und die Verringerung von oxidativem Stress. [3] Eine Vielzahl von positiven Effekten auf verschiedenste Organfunktionen wird vor allem dem Stilben Resveratrol nachgesagt. Es soll entzündungshemmend, antiproliferativ und antioxidativ wirken und somit koronaren Herzerkrankungen sowie Krebs vorbeugen. [15]
Bei der Untersuchung des antioxidativen Potentials von zehn verschiedenen Kräuterbittern und einem stark antioxidativ wirksamen Rotwein als Referenz wurden drei verschiedene Tests zugrunde gelegt. Zum einen zeigte der Vergleich, dass der Polyphenolgehalt von Underberg besonders hoch und vergleichbar mit dem des Rotweins ist und dass weiterhin das antioxidative Potential bedeutend höher liegt als bei den anderen Kräuterspirituosen. Studien zur Absorption und Bioverfügbarkeit der Polyphenolkomponenten stehen allerdings noch aus und sind für eine umfassende ernährungsphysiologische Bewertung von hoher Relevanz. [8]
Es gibt abschließend auch Studien, die darauf hinweisen, dass regelmäßiger Rotweinkonsum keinen grundlegenden Effekt auf den Gesundheitsstatus oder das Sterberisiko besitzt. [9] Kritiker des „French Paradox“ argumentieren häufig mit sozioökonomischen Faktoren. So geht ein moderater Weinkonsum häufig mit einem entspannten Lebensstil und somit weniger Stress einher. [11] Weiterhin sei moderates Trinken ein Zeichen eines höheren sozialen Standards, wodurch sich ein vorteilhaftes klinisch-biologisches Profil ergibt. Auch die Verfälschung von Studien durch Berücksichtigung von ehemaligen Trinkern als Nicht-Trinker wird bemängelt. Die Anzahl an Krankheitsfällen von Nicht-Trinkern nimmt bei dieser falschen Grundannahme dann gegenüber moderaten Trinkern deutlicher zu. [9]
Studien zur gesundheitsfördernden Wirkung eines moderaten Alkoholkonsums sind mit Vorsicht zu genießen und stark umstritten.
Die z. B. in Rotwein und Kräuterspirituosen enthaltenen Polyphenole zeigen jedoch ein deutliches, antioxidatives Potential und könnten deshalb eine positive Wirkung auf die Gesundheit haben.
Quellen
- Lippi, G., Francini, M., Guidi, GC. Red wine and cardiovascular health: The “French Paradox” revisited. International Journal of Wine Research, 2010, 2, S. 1-7.
- Böhm, M., Rosenkranz, S., Laufs, U. Das „French Paradox”. DMW-Deutsche Medizinische Wochenschrift 127.51/52, 2002, S. 2748-2756.
- Dávalos, A., Lasunción, MA. Health-promoting effects of wine phenolics. Wine chemistry and biochemistry, Springer New York, 2009, S. 571-591.
- Halliwell, B. Biochemistry of Oxidative Stress. Biochemical Society Transactions, 2007, 35, (5), S. 1147-1150.
- Belitz, H.D., Grosch, W. Lehrbuch der Lebensmittelchemie. Springer-Verlag Berlin-Heidelberg, 2008, S. 218-223 und 467-468.
- Shebis, Y., Iluz, D., Kinel-Tahan, Y., Dubinsky, Z., Yehoshua, Y. Natural antioxidants: function and sources. Food and Nutrition Sciences, 2013, 4, (6), S. 643-649.
- Pfaar, U., Kübler E., Gygax, D. Molekulare Regulation der Bildung und Inaktivierung reaktiver Sauerstoffspezies. Molekularmedizinische Grundlagen von para- und autokrinen Regulationsstörungen, Springer Berlin Heidelberg, 2006, S. 159-199.
- Imark, C, Kneubühl, M., Bodmer, S. Occurrence and activity of natural antioxidants in herbal spirits. Innovative Food Science & Emerging Technologies, 2000, 1.4, S. 239-243.
- Marco, B., Bertelli, A. Wine, alcohol and pills: what future for the French paradox? Life sciences, 2015, 131, S. 19-22.
- Chiva-Blanch, G., Arranz, S., Lamuela-Raventos, R. M., Estruch, R. Effects of wine, alcohol and polyphenols on cardiovascular disease risk factors: evidences from human studies. Alcohol and alcoholism, 2013, 48, (3), S. 270-277.
- Halbwirth, H. Polyphenole als Qualitätsfaktoren im Wein Polyphenols. Tagungsbericht 2013, 2013, S. 305.
- http://www.deutscheweinakademie.de/themen/kolumne-nachgeforscht/2017/die-j-kurve-existiert-nebenschauplaetze-wirken-zuweilen-nach/ vom 21.06.2017, Zugriff: 24.07.2017.
- Corrao, G., Bagnardi, V., Zambon, A., La Vecchia, C. A meta-analysis of alcohol consumption and the risk of 15 diseases. Preventive medicine, 2004, 38, (5), S. 613-619.
- Di Castelnuovo, A., Costanzo, S., Bagnardi, V., Donati, M. B., Iacoviello, L., De Gaetano, G. Alcohol dosing and total mortality in men and women: an updated meta-analysis of 34 prospective studies. Archives of internal medicine, 2006, 166, (22), S. 2437-2445.
- Weiskirchen, S., Weiskirchen, R. Resveratrol: how much wine do you have to drink to stay healthy? Advances in Nutrition: An International Review Journal, 2016, 7, (4), S. 706-718.
